Chapitre
2 : suivi temporel d’une réaction chimique
Etat final d’un
système chimique : étude par spectrophotométrie et titrage(Nouvelle
Calédonie novembre 2004) corrigé
Les
ions iodure (I-) réagissent avec les ions peroxodisulfate (S2O82-).L’équation
associée à la réaction s’écrit : 2I-(aq) + S2O82-(aq)
= I2(aq) + 2SO42-(aq) (1)En présence d’ions iodure, le diiode
se transforme en ions triiodure (I3-) de couleur brune.
Pour simplifier l’écriture, on raisonnera à partir de l’équation (1) sans tenir
compte de la formation des ions triiodure.A un instant pris pour origine des dates (t = 0
min), on réalise un mélange réactionnel S à partir d’un volume V1 =
10,0 mL de solution aqueuse d’iodure de potassium (K+(aq)
+ I-(aq)) de concentration molaire en soluté apporté c1
= 5,0×10-1 mol.L-1 et d’un volume V2 = 10,0 mL
de solution aqueuse de peroxodisulfate de sodium (2Na+(aq)
+ S2O82-(aq)) de concentration
molaire en soluté apporté c2 = 5,0×10-3 mol.L-1.
1. Suivi spectrophotométrique de la transformation chimique.
On souhaite étudier la formation du diiode au
cours du temps par spectrophotométrie. Un prélèvement du mélange réactionnel S
est introduit rapidement dans la cuve d’un spectrophotomètre dont la longueur
d’onde est réglée sur une valeur adaptée à l’absorption par le diiode. On
admettra que le diiode est la seule espèce colorée présente dans le mélange et
qu’au cours de l’expérience la température de la solution reste constante. Les
résultats des mesures d’absorbance en fonction du temps sont rassemblés dans le
tableau ci-dessous :
|
t (min) |
1 |
2 |
4 |
6 |
8 |
10 |
12 |
14 |
16 |
18 |
20 |
30 |
40 |
50 |
60 |
90 |
|
A |
0,08 |
0,13 |
0,23 |
0,31 |
0,39 |
0,45 |
0,50 |
0,55 |
0,59 |
0,62 |
0,65 |
0,74 |
0,77 |
0,79 |
0,79 |
0,79 |
1.1. La spectrophotométrie est une méthode non destructive
pour suivre l’évolution d’un système chimique. Proposer une autre méthode de
suivi cinétique non destructive.
1.2. La mesure de l’absorbance A de solutions
aqueuses de diiode de différentes concentrations molaires c montre que A est
proportionnelle à c. On détermine le coefficient de proportionnalité k à partir
du couple de valeurs (c = 5,0×10-3 mol.L-1 ; A =
1,70).
1.2.1.
Calculer la valeur du coefficient de proportionnalité k et préciser son unité.
1.2.2. Donner l’expression
de la quantité de matière n(I2)t en fonction de
l’absorbance au cours du temps de k et des volumes V1 et V2.
1.2.3.
Calculer la quantité de matière de diiode formé à l’instant de date t = 14 min.
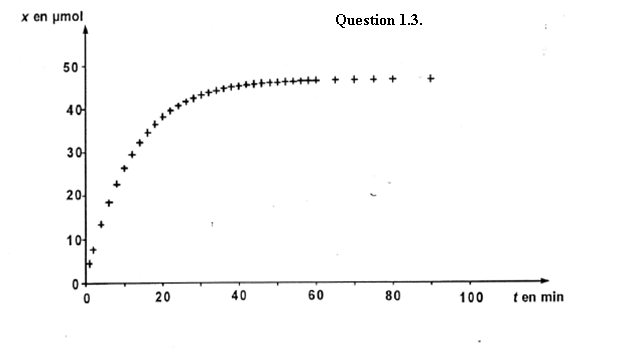
1.3. On note x l’avancement
de la réaction à l’instant de date t. à cet instant, la quantité de diiode
formé est égale à x.
En utilisant les valeurs
expérimentales et la relation donnée à la question 1.2.3., on obtient la courbe
traduisant l’évolution de x en fonction du temps ; cette courbe est
représentée sur l’ANNEXE A RENDRE AVEC LA COPIE.
Donner une méthode qui
permettrait d’obtenir plus rapidement la même quantité finale de diiode à
partir du même mélange réactionnel S.
2. titrage du diiode formé
après 90 minutes de réaction.
On veut vérifier par un titrage la quantité de
matière de diiode formé à l’instant de date t = 90 min. Pour cela, à cet
instant, on introduit dans un erlenmeyer contenant de l’eau glacée un
échantillon de volume V = 5,0 mL du mélange réactionnel S. A l’aide d’une
solution étalon de thiosulfate de sodium
(2Na+(aq)
+ S2O32-(aq)) de concentration molaire
en soluté apporté c’ = 2,5×10-3
mol.L-1, on titre le diiode présent dans l’échantillon en
présence d’un indicateur de fin de réaction. L’équivalence est atteinte pour un
volume V’E = 9,2 mL.
L’équation associée à la réaction support du
titrage est :
I2(aq)
+ 2S2O32-(aq) = 2 I-(aq) + S4O62-(aq)
2.1. Représenter sur la copie le schéma du dispositif de titrage
en précisant le nom du matériel et la nature des solutions.
2.2. Définir l’équivalence du titrage.
2.3. Exploitation du
titrage.
2.3.1. En exploitant le
résultat du titrage, exprimer littéralement en fonction de c’ et de V’E
la quantité de matière de diiode formé, à l’instant de date t = 90 min, dans le
mélange réactionnel décrit au début de l’exercice. On notera cette quantité de
matière n(I2)t= 90 min
2.3.2. Calculer la valeur de cette quantité
de diiode formé.
2.3.3. Comment vérifier
cette valeur à l’aide des données de l’épreuve ?
3. Étude théorique et bilan comparatif.
3.1. L’équation (1) associée à la réaction entre
les ions iodure et les ions peroxodisulfate est rappelée ci-dessous :
2I-(aq)
+ S2O82-(aq) = I2(aq) +
2SO42-(aq)
(1)
Les couples mis en jeu sont
I2(aq) / I-(aq) et S2O82-(aq)
/ SO42-(aq)
A partir des demi-équations
que l’on nommera retrouver l’équation (1) associée à la réaction.
3.2. La transformation chimique est supposée
totale.
3.2.1. En utilisant les
données concernant le mélange réactionnel S, à l’instant t = 0 s, défini en
introduction de l’exercice, compléter le tableau d’avancement figurant sur
l’ANNEXE A RENDRE AVEC LA COPIE.
3.2.2. En déduire l’avancement maximal de la
réaction et la quantité de matière maximale en diiode formée.
3.3. On appelle écart
relatif d’une valeur expérimentale nexp(I2) par rapport à
la valeur théorique attendue nth(I2) le rapport : 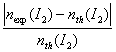
Comparer le résultat
expérimentale au résultat théorique. Commenter.
3.4 Déterminer la concentration en
ion sulfate à t = 10 min
ANNEXE
 A RENDRE AVEC LA COPIE
A RENDRE AVEC LA COPIE
|
Relation stœchiométrique |
2I–
(aq) + S2O82–(aq) =
I2 (aq) +
2 SO42– (aq) |
||||
|
Avancement |
Quantité de matière en
mol |
||||
|
État
initial |
|
|
|
||
|
Au
cours de la transformation |
|
|
|
|
|
|
État
final attendu |
xmax |
|
|
|
|