Chapitre 5 : constante d’acidité
d’un couple acide base
A propos de l’acide formique ( Bac
USA 2004) corrigé
Q1
Pour se
défendre, les fourmis utilisent deux moyens : leurs mandibules et la
production d’acide formique. Les mandibules servent a immobiliser l’ennemi
tandis que l’acide formique brûle la victime. Une fourmi se sentant menacée se dresse sur ses deux pattes arrière
et peut projeter sur l’ennemi un jet d’acide formique à plus de 30 cm grâce à
son abdomen. L’acide formique (ou acide méthanoïque) soluble dans l’eau a pour
formule semi-développée HCOOH. On se propose d’étudier quelques propriétés
d’une solution aqueuse de cet acide.
Données :
- Masses
molaires atomiques : M (C) = 12
g.mol-1 ;
M (H) =
1 g.mol-1 ; M(O) = 16 g.mol-1
-
Constante d’acidité à 25 °C :
KA
(HCOOH/HCOO-) = 1,8 x 10-4
-
Conductivité molaire ionique à 25 °C (conditions de l’expérience) : l(H3O+)
= 35,0 x 10-3 S.m2.mol-1 ;
l(HCOO-)
= 5,46 x 10-3 S.m2.mol-1.
On
rappelle l’expression de la conductivité s d’une solution en fonction des
concentrations molaires des espèces ioniques Xi dissoutes :
![]()
a) Dans
une fiole jaugée de volume Vo = 100 mL, on introduit une masse m
d’acide formique puis on complète cette fiole avec de l’eau distillée jusqu’au
trait de jauge puis on homogénéise. On dispose alors d’une solution d’acide
formique de concentration molaire Co = 0,01 mol.L-1 ;
Calculer sa masse m
b)
Ecrire l’équation de la réaction associée à la transformation de l’acide
formique en présence d’eau.
Q2
a)
Etablir un tableau d’avancement correspondant à cette transformation chimique,
en fonction de Co, Vo, xmax et xeq.
On note xeq l’avancement à l’état d’équilibre et xmax
l’avancement de la réaction supposée totale.
b)
Exprimer le taux d’avancement final t en fonction de la concentration
en ions oxonium à l’équilibre [H3O+]eq et de Co.
c)
Donner l’expression du quotient de réaction à l’état d’équilibre Qr,eq.
Montrer que ce quotient peut s’écrire sous la forme :
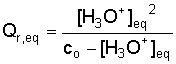
Q3
a)
Exprimer la conductivité de la solution d’acide formique à l’état d’équilibre
en fonction des conductivités molaires ioniques des ions présents et de la
concentration en ions oxonium à l’équilibre [H3O+]eq.
b)
La mesure de la conductivité de la solution So donne s =
0,05 S.m-1 à 25 °C. En utilisant les relations obtenues précédemment
compléter le tableau ci-dessous.
|
Solution |
So |
S1 |
|
Ci(mol.L-1) |
0,010 |
0,10 |
|
s(S.m-1) |
0,050 |
0,17 |
|
[H3O+]eq
(mol.m-3) |
|
4,2 |
|
[H3O+]eq
(mol.L-1) |
|
4,2 x
10-3 |
|
t(%) |
|
4,2 |
|
Qreq |
|
1,8 x
10-4 |
c)
Comparer la valeur expérimentale Qr,eq avec la valeur de la
constante KA du couple HCOOH, HCOO-.
Q4
On
réalise la même étude, en utilisant une solution S1 d’acide formique
de concentration C1 = 0,10 mol.L-1. Les résultats obtenus
sont indiqués dans le tableau ci-dessus. En déduire l’influence de la
concentration de la solution sur :
a) le taux d’avancement de la
réaction
b) le quotient de réaction dans
l’état d’équilibre.