Chapitre 9 : électrolyse, une
transformation forcée
Pile et électrolyse (bac Maroc 2004) corrigé
Masse molaire atomique du
cuivre : M(Cu) = 63,5 g.mol-1 ; Charge élémentaire de l’électron : e = 1,6.10–19
C ;Nombre d’Avogadro : N = 6,02.1023 mol-1 ; Le faraday F = 96500 C/mol
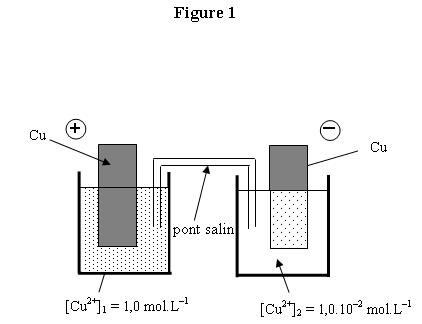
1. PILE DE CONCENTRATION
On
considère une pile constituée de deux électrodes de cuivre plongeant chacune
dans des solutions de sulfate de cuivre de concentrations différentes. Chaque
solution a pour volume V = 100 mL et la concentration initiale des ions
positifs est : [Cu2+]1 = 1,0 mol.L-1 et
[Cu2+]2 = 1,0.10 –2 mol.L-1
1.1. Équations des réactions
1.1.1. Écrire les demi-équations des réactions se produisant
aux électrodes en accord avec la polarité donnée
sur la figure 1.
1.1.2. Donner le nom de chaque demi-réaction.
1.1.3. Écrire l’équation de la réaction s’effectuant dans la
pile. Pour la réaction considérée la constante d’équilibre vaut : K = 1.
1.2. Évolution de la pile
1.2.1. Calculer la valeur du
quotient réactionnel initial Qr, i.
1.2.2 Cette valeur est-elle
cohérente avec la polarité proposée ?
1.3. Étude de la pile
On fait débiter la pile dans un conducteur ohmique et un ampèremètre.
1.3.1. Compléter le schéma de la figure 1 en annexe à
rendre avec la copie. en indiquant par des flèches le sens du courant et le
sens de déplacement des électrons dans le circuit extérieur constitué d’un
ampèremètre et d’un conducteur ohmique.
1.3.2. Que peut-on dire des
concentrations finales quand l’état d’équilibre est atteint ?
1.3.3 On fait débiter la pile pendant ![]() avec une intensité I =100 mA. Calculer la quantité
d’électricité Q débitée par la pile, et en déduire la quantité de matière
d’électrons n(e-) qui a circulé dans la pile.
avec une intensité I =100 mA. Calculer la quantité
d’électricité Q débitée par la pile, et en déduire la quantité de matière
d’électrons n(e-) qui a circulé dans la pile.
1.3.4
En déduire la quantité de matière d’ion n(Cu2+)1 qui a
disparue dans le compartiment 1.
1.3.5
Quelle est alors la nouvelle concentration en ion cuivre [Cu2+]1’
dans le compartiment 1 ?
2. DÉPÔT DE CUIVRE PAR
ÉLECTROLYSE
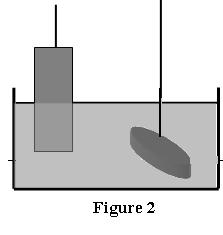
2.1. On remplace une électrode de cuivre par une bague en
métal conducteur que l’on veut recouvrir de cuivre.
2.1.1. Quel appareil est-il nécessaire de rajouter dans le montage
précédent pour réaliser ce dépôt ?
2.1.2. Écrire les demi-équations aux électrodes en justifiant
votre raisonnement.
2.1.3. En déduire le sens des électrons, le sens du courant
et la polarité dans le montage puis compléter la
figure 2 (en annexe à rendre avec la copie).
2.2. L’électrolyse fonctionne pendant une heure à une
intensité constante I = 400 mA.
2.2.1. Déterminer la quantité d’électricité correspondante notée
Q.
2.2.2. En déduire la quantité de matière d’électrons, notée n(e–),
qui a circulé pendant cette durée.
2.2.3. Quelle relation existe-t-il entre la quantité de
cuivre qui a disparu ndisp (Cu2+) et la quantité de matière n(e–) d’électrons qui a
circulé ?
2.2.4. En déduire la quantité de matière ndép(Cu)
déposée.
2.2.5. Quelle est la masse m(Cu) correspondante ?
ANNEXE n°1 à rendre avec la copie