|
|
|
Constitution et transformation de la matière |
4.
Suivi temporel et modélisation macroscopique (vitesse de réaction
chimique) |
||||||||||||
|
|
|
Animations |
Vidéos de cours |
||||||||||
|
Cours : Activités expérimentales Puissances de 10,
notation scientifique Unités légales
du système international / conversion Méthode de
résolution d’exercices Résoudre une
équation à une inconnue Programme officiel
|
Exercice (programme 2001-2011) 1.
Suivi spectrophotométrique d'une réaction 2. Chimie et spéléologie
(Liban Bac 2004) 3. Du chlore dans l’eau de javel
(national 09/04) 4.
Fermentation du vin (Polynésie 2005) 5. Etude
cinétique par conductimétrie 6. Deux antiseptiques
(d’après Calédonie 2005) 7. eau de Javel (Antille
Guyane 2008) 8. titrage par une
réaction lente (Polynésie 2007) 8. DS chapitre 4
et 8 ( 03/21) Réaction d’ordre
1 ; pkA, diagramme de prédominance) 9. DS Cinétique de la réaction entre la propanone et les ions triiodure 3/21 (D’après le sujet chimie, banque CCP, 2013) |
Vitesse
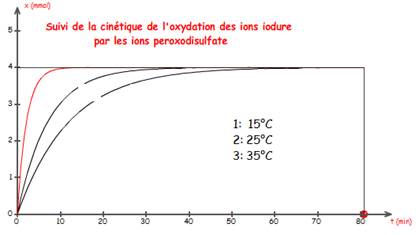
de réaction entre les ions iodure et peroxodisulfate
Mécanisme de
catalyse enzymatique
|
Décomposition de l’eau oxygénée. Catalyse homogène, hétérogène, enzymatique Surface
de contact et vitesse de réaction Comment
déterminer graphiquement le temps de demi-réaction(exemple) Vitesse de réaction,
définition Suivi de réaction par méthode physique |
||||||||||